【PD】6-OHDA诱导PD动物模型评价方案
2022-06-14 15:56管理员
一、动物模型命名
侧脑室注射六羟多巴胺(6-OHDA)诱导帕金森(AD)模型
二、模型制备规范(环境、设备、操作程序、实验操作规程)
SPF级SD大鼠术前禁食12h后,腹腔注射2%戊巴比妥钠(50mg/kg)麻醉后将大鼠复位、四肢外展,俯卧位将其固定于立体定位仪上,将大鼠舌头轻轻拉向一边保持呼吸畅通。剔除颅顶部毛将头部固定在脑立体定位仪上碘伏消毒行正中切口分离皮下肌肉组织以棉球擦净血迹参照包新民所著《大鼠脑立体定位图谱》,确定纹状体左右两个注射点的坐标:A/P(距前卤中心点后)1mm;L/R(距前卤中心左右)-3mm;O/V(距脑膜表面深度)-5.5mm。在选定的坐标点用微型颅钻钻开颅骨,用微量注射器将2μg/μL的6-OHDA 5μL分别注入上述两个位点,注射速度为1μL /min,注毕留针10min,退针速度为1mm/min,以防药液溢出。退针后缝合头皮,术毕腹腔注射青霉素10万U/100g,将大鼠转移到保温垫上至苏醒。
三、模型评价方法与指标体系(该模型制备采用的生理、生化和病理方法,包括行为、影像、生理生化和组织切片等技术设备,仪器设备满足模型评价的要求,指标完善,条件稳定。)
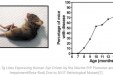
1、旋转行为检测 分别在术后1周、2周、4周、6周、8周和10周于颈部皮下注射0.1%阿扑吗啡(APO 1mL/kg),诱发大鼠向健侧的单向旋转行为,PD模型旋转检测仪记录动物向对侧旋转情况,旋转360°为1次,每次记录30min。一般认为,平均旋转次数≥7转/min为成功的PD大鼠模型。除旋转行为外,还需注意观察是否伴有震颤、活动迟缓、抓握、嗅探等异常行为。
2、造模后生化及病理变化
(1)免疫组织化学观测:PD模型大鼠左侧中脑黑质区酪氨酸羟化酶(TH)反应阳性神经元较右侧明显减少,与对照组的左侧和右侧比较均有极显著差异,而PD模型大鼠的右侧TH反应阳性神经元与对照组无明显差异。术后2周、3周、4周、6周的成功PD模型鼠TH反应阳性神经元与术后1周相比明显减少,术后3周、4周、6周同术后2周比较亦有显著差异,而术后3周、4周、6周的TH反应阳性神经元之间则无明显差异。
(2)电镜观察:透射电镜下可见PD模型鼠损伤侧黑质区部分神经元变性坏死,胞膜破裂或残缺,核仁破裂。部分神经元细胞质内溶酶体增多,线粒体和内质网轻度增生,胞核固缩不明显,呈早期凋亡样改变。一部分神经元则出现染色质致密或凝固成边界清晰的块状物,有些出现细胞器水肿,胞膜不清晰及皱缩,细胞质内有电子致密物沉积,溶酶体消失,表现为晚期凋亡样改变。
四、模型的安全性评价(监督管理、处置措施、微生物菌株管理、细胞系描述、遗传分析、对环境和生态影响评估等。)
模型使用的6-OHD作为选择性的神经毒素,由于它可以去除中脑黑质的多巴胺能神经元而被广泛用于多种动物的PD模型制作。
五、有助于动物模型鉴定和评价的其它材料(如影响模型制备、实验操作的注意事项,以及对造模的成功率、成活时间、死亡率的影响等。)
1、实验时选用大鼠体重尽量在要求范围内,选择体重在180~250g的大鼠,这类大鼠耐受力强,头部易被脑立体定位仪固定; 麻醉剂量严格控制在30-50mg/kg,避免麻醉过量。
2、注射靶点的确定,应根据所用的定向图谱及立体定向仪认真调整验证;
3、6-OHDA应新鲜配制,颜色以橙红色为准;注药速度与留针也很重要;
4、手术器械严格消毒,防止手术感染,手术创伤应尽可能小,严格无菌操作;
5、颅骨钻孔时应注意深浅,一旦有突破感立即停止,防止引起大量出血;微量注射器的针尖部要稍微磨钝,以缩小药剂渗透的范围;
6、SD大鼠在造模后,一定注意保温、吸痰。根据大鼠的夜间习性,下午或晚上造模的成活率更高些。